精选普通高中冬季学业水平考试化学测试题(甘肃省)
编辑:
2016-10-19
20.【题文】将0.4g NaOH和1.06g Na2CO3混合并配成溶液,向溶液中滴加0.1mol/L的稀盐酸。下列图像能正确表示加入盐酸体积和生成CO2的物质的量的关系的是
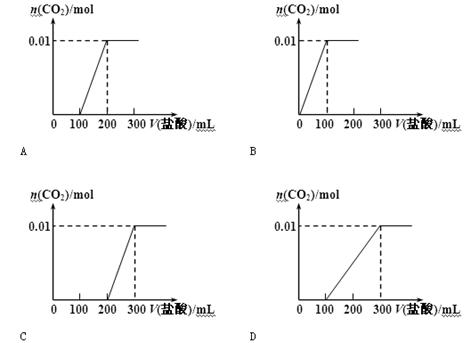
答案
【答案】C
解析
【解析】
试题分析:加入盐酸后依次发生以下三个反应,OH—+H+=H2O、 CO32—+H+=HCO3—、
HCO3—+ H+=H2O+CO2,故C正确。
考点:本题考查碳酸钠的性质。
21.【题文】(8分)完成下列各题。
(1)中国的瓷器驰名世界,制备陶瓷是以粘土[主要成分Al2Si2O5(OH)4]为原料,经高温烧结而成。若以氧化物形式表示粘土的组成,应写为: 。
(2)如果胃酸过多,可服用 (填写化学式)缓解症状,但如果患有胃溃疡,则不能服用,以防止胃穿孔。
(3)赏心悦目的雕花玻璃是用氢氟酸对玻璃进行刻蚀而制成的,这一过程中发生反应的化学方程式为: 。
(4)二氧化氯(ClO2)是一种高效、广谱、安全的杀菌、消毒剂,工业上是用氯酸钠(NaClO3)与盐酸反应生产ClO2的,反应过程中同时会生成氯气。写出该反应的化学方程式: 。
答案
【答案】(1)Al2O3·2SiO2·2H2O (2)NaHCO3 (3)SiO2+4HF=SiF4↑+2H2O
(4)2NaClO3+4HCl=2ClO2↑+ Cl2↑+2NaCl+2H2O
解析
【解析】
试题分析:(1)以氧化物形式表示复杂的盐的化学式,先写活泼金属的氧化物,再写非金属氧化物,Al2Si2O5(OH)4以氧化物形式表示为Al2O3·2SiO2·2H2O;(2)碳酸氢钠能和盐酸反应,所以碳酸氢钠能治疗胃酸过多,但由于反应生成二氧化碳,所以患有胃溃疡的病人不能服用,以防止胃穿孔;(3)氢氟酸对玻璃进行刻蚀的方程式为SiO2+4HF=SiF4↑+2H2O;(4)氯酸钠(NaClO3)与盐酸反应生产ClO2的,反应过程中同时会生成氯气的方程式2NaClO3+4HCl=2ClO2↑+ Cl2↑+2NaCl+2H2O。
考点:本题考查化学方程式。
22.【题文】(10分)下图中A~J分别代表相关反应的一种物质,图中有部分生成物未标出。
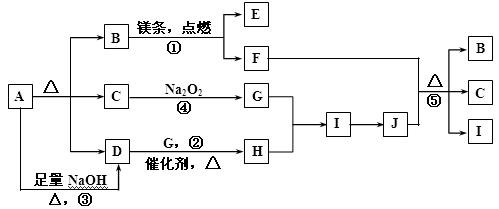
已知:A分解得到等物质的量的B、C、D;反应①为:2Mg+CO2
![]()
2MgO+C。
(1)A的化学式 。
(2)写出反应②的化学方程式: 。
(3)写出反应③的离子方程式: 。
(4)写出反应⑤的化学方程式: 。
(5)在反应④中,当生成标准状况下2.24 L G时,转移电子 mol。
答案
【答案】(1)NH4HCO3 (2)4NH3+5O2
![]()
4NO+6H2O
(3)NH4++HCO3-+2OH-
![]()
NH3↑+CO32-+2H2O
(4)C+4HNO3(浓)
![]()
CO2↑+4NO2↑+2H2O (5)0.2
解析
【解析】
试题分析:A分解得到等物质的量的B、C、D,B为CO2,C能和过氧化钠反应,所以C为H2O;A能与氢氧化钠反应得到D,所以D为氨气,故A为NH4HCO3;反应②为氨气的催化氧化,反应方程式为(2)4NH3+5O2
![]()
4NO+6H2O;③为NH4HCO3与NaOH反应,离子方程式为NH4++HCO3-+2OH-
![]()
NH3↑+CO32-+2H2O;J为硝酸,F为碳,反应⑤的方程式为C+4HNO3(浓)
![]()
CO2↑+4NO2↑+2H2O ;过氧化钠和二氧化碳反应中,过氧化钠既是氧化剂又是还原剂,故生成2.24 L氧气时,转移电子0.2mol
考点:本题考查物质推断。
23.【题文】(8分)一定量的氢气在氯气中燃烧,所得混合物用100mL 3.00mol·L-1的NaOH溶液恰好完全吸收,测得溶液中含有NaClO的物质的量为0.10mol。
(1)上述变化中涉及三个化学反应,其中一个反应为H2 +Cl2
![]()
2HCl,请写出另外两个反应的离子方程式: 、 。
(2)参加反应的氢气和氯气的物质的量之比n(H2) : n(Cl2)为 。
(3)工业制取漂白粉的原料是氯气和石灰乳,漂白粉的有效成分为 。
答案
【答案】(1)H++OH-=H2O Cl2+2OH-=Cl-+ClO-+H2O (2)1:3 (3)Ca(ClO)2(或次氯酸钙)
解析
【解析】
试题分析:(1)还有氯化氢和氢氧化钠、氯气和氢氧化钠反应,离子方程式为H++OH-=H2O Cl2+2OH-=Cl-+ClO-+H2O;(2)氢氧化钠的物质的量为0.3mol;根据质量守恒, NaClO的物质的量为0.10mol,NaCl的物质的量为0.2mol;氯气和氢氧化钠反应,生成NaClO和NaCl的物质的量比为1:1,盐酸和氢氧化钠反应生成NaCl的物质的量为0.1mol;所以参加反应的氢气为0.05mol、参加反应的氯气为0.15mol;(3)漂白粉的有效成分为Ca(ClO)2;
考点:本题考查氯气的性质。
24.【题文】(16分)某研究性学习小组利用以下装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置。
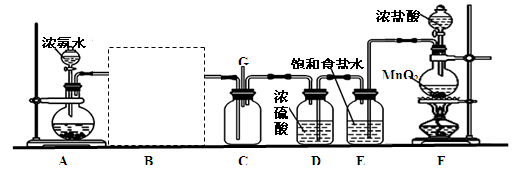
请回答下列问题:
(1)为了快速制备氨气,装置A中烧瓶内的固体可以是 (填序号)。
①二氧化硅
②过氧化钠
③生石灰
④氢氧化钠固体
⑤氯化钙
(2)请在B处虚线框内画上合适的装置图并注明所装试剂名称。
(3)装置F中发生反应的离子方程式为: 。
(4)装置D和E的位置 (填“能”或“不能”)调换,装置E的作用是: 。
(5)通入C装置的两根导管左边较长、右边较短,目的是: 。
(6)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一。请写出发生反应的化学方程式,并标出电子转移的方向和数目: 。
(7)从装置C的G处逸出的尾气可能含有污染环境的气体,如何处理? 。
答案
【答案】(1)③④ (2)见右图

(3)MnO2+4H++2Cl-
![]()
Mn2++Cl2↑+2H2O
(4)不能 除去氯气中混有的HCl (5)使密度大的氯气与密度小的氨气能够快速且充分混合,反应更迅速 (6)
![]()
(7)将尾气通过一倒置的漏斗通入盛有NaOH溶液的烧杯中
解析
【解析】
试题分析:(1)为了快速制备氨气可以用浓氨水和氧化钙(或氢氧化钠)反应;(2)B处装置为氨气的干燥装置,用盛有碱石灰的干燥管,如图所示

;
(3)装置F中用二氧化锰和浓盐酸制取氯气,发生反应的离子方程式为
MnO2+4H++2Cl-
![]()
Mn2++Cl2↑+2H2O;(4)装置D和E的位置调换就达不到干燥氯气的目的,所以D和E的位置不能调换;装置E的作用是除去氯气中混有的HCl;(5)氨气的密度比氯气的小,两根导管左边较长、右边较短,目的是使密度大的氯气与密度小的氨气能够快速且充分混合,反应更迅速;
(6)浓厚的白烟是氯化铵、空气的主要成分之一是氮气,反应的方程式为
![]()
(7)从装置C的G处逸出的尾气可能为氯气,为防止污染,将尾气通过一倒置的漏斗通入盛有NaOH溶液的烧杯中。
考点:本题考查氯气、氨气性质。
25.【题文】(10分)将铝和铁组成的混合物11g,加入到200mL5mol/L盐酸中,反应后盐酸的浓度变为1mol/L(溶液体积变化忽略不计)。求:
(1)反应中消耗HCl的物质的量。
(2)混合物中铝和铁的物质的量。
(3)欲使上述溶液中的Al3+完全转化为AlO2-,至少需要加入2mol/L NaOH溶液的体积。
答案
【答案】(1) 0.8mol ;(2)n(Al)=0.2mol,n(Fe)=0.1mol ;(3)600mL
解析
【解析】
试题分析:(1)n(HCl)消耗="5mol/L" ×0.2L-1.0mol/L×0.2L=0.8mol
(2)设铝和铁的物质的量分别为x、y
2Al + 6HCl = AlCl3 + 3H2↑ Fe + 2HCl = FeCl2 + H2↑
2mol 6mol 1mol 2mol
x 3x y 2y
27x+56y=11g
3x+2y=0.8mol 解得x="0." 2mol y=0.1mol
即:n(Al)=0.2mol,n(Fe)=0.1mol (4分)
(3)Fe2++2OH-=Fe(OH)2↓ Al3++4OH-=AlO2-+2H2O
n(NaOH)=" 1.0mol/L×0.2L+0.1mol×2+0.2mol×4=1.2" mol
V(NaOH)=" 1.2" mol÷2.0mol/L=0.6L,即600mL
考点:本题考查化学计算。
相信大家在阅读了普通高中冬季学业水平考试化学测试题之后,一定要及时漏题追踪,做好笔记哦。
相关推荐:
标签:高考会考试题
免责声明
精品学习网(51edu.com)在建设过程中引用了互联网上的一些信息资源并对有明确来源的信息注明了出处,版权归原作者及原网站所有,如果您对本站信息资源版权的归属问题存有异议,请您致信qinquan#51edu.com(将#换成@),我们会立即做出答复并及时解决。如果您认为本站有侵犯您权益的行为,请通知我们,我们一定根据实际情况及时处理。