精选普通高中冬季学业水平考试化学测试题(甘肃省)
编辑:
2016-10-19
11.【题文】除去下列物质中的杂质(括号内为杂质),所选用的试剂和方法都正确的是
选项
物质
试剂
方法
A
SiO2(Al2O3)
氢氧化钠溶液
过滤
B
AlCl3(MgCl2)
氢氧化钠溶液
过滤
C
CO2(SO2)
饱和碳酸氢钠溶液
洗气
D
乙醇(水)
汽油
萃取、分液
答案
【答案】C
解析
【解析】
试题分析:SiO2和Al2O3都能和氢氧化钠反应,改用稀盐酸,故A错误;AlCl3和MgCl2都能和氢氧化钠反应,故B错误;SO2与饱和碳酸氢钠溶液反应生成二氧化碳,故C正确;乙醇易溶于水,故不能用汽油萃取,用分馏的方法分离,故D错误。
考点:本题考查混合物的分离。
12.【题文】下列实验能达到预期目的的是
A.检验溶液中是否含有CO32-:滴加稀盐酸,将产生的气体通入澄清石灰水
B.检验溶液中是否含有SO42-:先滴加氯化钡溶液,再滴加稀盐酸
C.检验溶液中是否含有Fe2+:先滴加氯水,再滴加KSCN溶液
D.检验溶液中是否含有NH4+:先滴加浓NaOH溶液并加热,再用湿润的红色石蕊试纸
答案
【答案】D
解析
【解析】
试题分析:CO32-、HCO3-滴加稀盐酸,都能生成二氧化碳气体,故A错误;先滴加氯化钡溶液,再滴加稀盐酸,产生的沉淀可能是氯化银,故B错误;氯水能把Fe2+:氧化为Fe3+,故C错误;选D。
考点:本题考查离子检验。
13.【题文】下列推断正确的是
选项
事实
结论
A
SiO2可用于制光导纤维
SiO2有导电性
B
铝箔在酒精灯火焰上加热熔化但不滴落
铝箔表面氧化铝熔点高于铝
C
Cl2的水溶液可以导电
Cl2是电解质
D
常温下铁、铜均不溶于浓硫酸
常温下铁、铜与浓硫酸均不反应
答案
【答案】B
解析
【解析】
试题分析:SiO2不能导电,故A错误;Cl2是既不是电解质,又不是非电解质,故B错误;常温下铁与浓硫酸发生钝化,故D错误,选B。
考点:本题考查元素化合物的性质。
14.【题文】甲、乙两烧杯中各盛有100mL 3mol/L的盐酸和氢氧化钠溶液,向两烧杯中分别加入等质量的铝粉,反应结束后收集到相同条件下气体体积比为甲:乙=1:2,则加入铝粉的质量为
A.5.4g B.3.6g C.2.7g D.1.6g
答案
【答案】A
解析
【解析】
试题分析:若铝完全反应生成氢气一样多,甲烧杯放出氢气少,说明甲中铝剩余;若盐酸和氢氧化钠全反应生成氢气1:3,实际为1:2,说明乙中氢氧化钠剩余,甲中盐酸完全反应,所以甲放出的气体为(0.1L×3mol/L)÷2=0.15mol,乙放出的气体为0.3mol;乙中氢氧化钠剩余,铝完全反应,所以铝的质量为0.3mol
![]()
![]()
=5.4g。
考点:本题考查铝的性质。
15.【题文】下列现象或事实能用同一原理解释的是
A.水玻璃和亚硫酸钠长期暴露在空气中均易变质
B.浓硝酸和氯水均用棕色试剂瓶保存
C.NaCl固体中混有NH4Cl或I2,均可用加热法除去
D.浓硫酸和浓盐酸长期暴露在空气中浓度均降低
答案
【答案】B
解析
【解析】
试题分析:水玻璃易吸收空气中二氧化碳变质,亚硫酸钠在空气中被氧气氧化而变质,故A错误;浓硝酸和氯水见光易分解,均用棕色试剂瓶保存,故B正确;NH4Cl加热易分解, I2l加热易升华,故C错误;浓硫酸具有吸水性,长期暴露在空气中浓度均降低。浓盐酸易挥发,长期暴露在空气中浓度均降低,故D错误。
考点:本题考查元素化合物的性质。
16.【题文】与铁相似,金属锡能与盐酸反应生成氯化亚锡(SnCl2),氯化亚锡又能被氯化铁氧化为氯化锡(SnCl4)。则下列有关粒子氧化性和还原性强弱的比较中,正确的是
A.氧化性:Sn4+
C.还原性:Fe2+
答案
【答案】C
解析
【解析】
试题分析:氧化剂的氧化性大于氧化产物的氧化性、还原剂的还原性大于还原产物的还原性,故C正确。
考点:本题考查氧化性、还原性。
17.【题文】下列离子方程式正确的是
A.金属钠与水反应:Na +2H2O=Na++2OH-+ H2↑
B.金属铝投入NaOH溶液中:Al+2OH-=AlO2-+H2↑
C.稀硝酸中加入过量铁粉:Fe + 4H+ + NO3- = Fe3+ + NO↑ + 2H2O
D.FeCl2酸性溶液放在空气中变质:4Fe2+ + 4H+ + O2 = 4Fe3+ + 2H2O
答案
【答案】D
解析
【解析】
试题分析:金属钠与水反应:2Na +2H2O=2Na++2OH-+ H2↑,故A错误;金属铝投入NaOH溶液中:
2Al+2OH-+2H2O=2AlO2-+3H2↑,故B错误;稀硝酸中加入过量铁粉,生成Fe2+,故C错误;FeCl2酸性溶液放在空气中被氧气氧化为Fe3+,故D正确。
考点:本题考查离子方程式。
18.【题文】下图装置中,干燥烧瓶中盛满某种气体,烧杯和滴管内盛放某种溶液。挤压滴管的胶头,下列与实验事实不相符的是
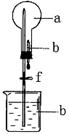
A.若a为NO,b为NaOH溶液,可出现无色喷泉
B.若a为HCl,b为AgNO3溶液,可出现白色喷泉
C.若a为CO2,b为NaOH溶液,可出现无色喷泉
D.若a为NH3,b为水(预先滴入少量酚酞溶液),可出现红色喷泉
答案
【答案】D
解析
【解析】
试题分析:NO和NaOH不反应,故A错误;HCl和AgNO3反应生成白色氯化银沉淀,故B正确;CO2,易与NaOH溶液反应,故C正确;氨气极易溶于水,水溶液呈碱性,故D正确。
考点:本题考查喷泉实验。
19.【题文】在15.2g铁和铜组成的合金中加入过量的硝酸溶液,合金完全溶解,同时生成气体X,再向所得溶液中加入足量的NaOH溶液,生成25.4g沉淀。则下列说法不正确的是
A.原合金中含0.1mol Fe、0.15mol Cu
B.25.4g沉淀为Cu(OH)2和Fe(OH)3的混合物
C.气体X中含0.3 mol NO、0.1 mol NO2
D.气体X中含0.3 mol NO2、0.1 mol NO
答案
【答案】C
解析
【解析】
试题分析:铁和铜组成的合金中加入过量的硝酸溶液,合金完全溶解,生成Cu(NO3)2和Fe(NO3)3,再向所得溶液中加入足量的NaOH溶液,生成Cu(OH)2和Fe(OH)3的混合物,设合金中有xmol Fe、ymol Cu,
![]()
,所以x=0.1mol,y=0.15mol;根据得失电子守恒,0.1mol Fe、0.15mol Cu共失去0.6mol电子,所以生成的气体不可能是0.3 mol NO、0.1 mol NO2,故C错误。
考点:本题考查化学计算。
标签:高考会考试题
免责声明
精品学习网(51edu.com)在建设过程中引用了互联网上的一些信息资源并对有明确来源的信息注明了出处,版权归原作者及原网站所有,如果您对本站信息资源版权的归属问题存有异议,请您致信qinquan#51edu.com(将#换成@),我们会立即做出答复并及时解决。如果您认为本站有侵犯您权益的行为,请通知我们,我们一定根据实际情况及时处理。