2015年酒泉中考化学备考资料:溶解度
编辑:sx_zhaoyl
2015-05-07
下面就是精品学习网为大家整理的“2015年酒泉中考化学备考资料:溶解度”,希望能为大家的学习带来帮助,不断进步,取得优异的成绩。
溶解度
1、固体的溶解度
(1)溶解度定义:在一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解的质量
四要素:①条件:一定温度②标准:100g溶剂③状态:达到饱和④质量:单位:克
(2)溶解度的含义:
20℃时NaCl的溶液度为36g含义:
在20℃时,在100克水中最多能溶解36克NaCl
或在20℃时,NaCl在100克水中达到饱和状态时所溶解的质量为36克
20℃时,易溶物质的溶解度为﹥10g,可溶物质的溶解度1g—10g,微溶物质的溶解度为0.01g—1g,难溶物质的溶解度为﹤0.01g。
(3)影响固体溶解度的因素:①溶质、溶剂的性质(种类) ②温度
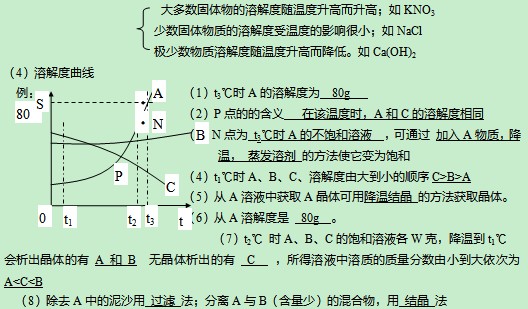
2、气体的溶解度
(1)气体溶解度的定义:在压强为101kPa和一定温度时,气体溶解在1体积水里达到饱和状态时的气体体积。
(2)影响因素: ①气体的性质 ②温度(温度越高,气体溶解度越小)
③压强(压强越大,气体溶解度越大)
3、混合物的分离
(1)过滤法:分离可溶物 + 难溶物
(2)结晶法:分离几种可溶性物质
分离:KCl和MnO2方法为过滤,步骤:溶解、过滤、蒸发,
NaCl和KNO3方法为结晶,步骤:溶解、冷却结晶。(冷却热饱和溶液法)
对溶解度受温度变化不大的物质采用蒸发溶剂的方法来得到晶体(如NaCl)。
对溶解度受温度变化比较大的物质采用冷却热的饱和溶液的方法来得到晶体(如KNO3、CuSO4)
冷却饱和CuSO4溶液析出晶体的化学式为CuSO4·5H2O。
结晶的两种方法:
1、蒸发溶剂,如NaCl(海水晒盐)
2、降低温度(冷却热的饱和溶液,如KNO3)
以上就是酒泉中考化学频道“2015年酒泉中考化学备考资料:溶解度”的全部内容,精品学习网小编希望同学们都能扎实的掌握学过的知识,取得好的成绩!
标签:酒泉中考化学
免责声明
精品学习网(51edu.com)在建设过程中引用了互联网上的一些信息资源并对有明确来源的信息注明了出处,版权归原作者及原网站所有,如果您对本站信息资源版权的归属问题存有异议,请您致信qinquan#51edu.com(将#换成@),我们会立即做出答复并及时解决。如果您认为本站有侵犯您权益的行为,请通知我们,我们一定根据实际情况及时处理。