高一上册期中化学平衡的移动必考知识点总结
编辑:sx_liax
2016-10-12
化学平衡常数,是指在一定温度下,可逆反应无论从正反应开始,还是从逆反应开始。精品学习网小编为大家准备了这篇高一上册期中化学平衡的移动必考知识点。
高一上册期中化学平衡的移动必考知识点总结
1、概念
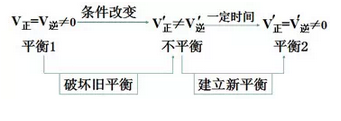
可逆反应中旧化学平衡的破坏、新化学平衡的建立,由原平衡状态向新化学平衡状态的转化过程,称为化学平衡的移动。
2、化学平衡移动与化学反应速率的关系
(1)v正>v逆:平衡向正反应方向移动。
(2)v正=v逆:反应达到平衡状态,不发生平衡移动。
(3)v正<v逆:平衡向逆反应方向移动。< p="">
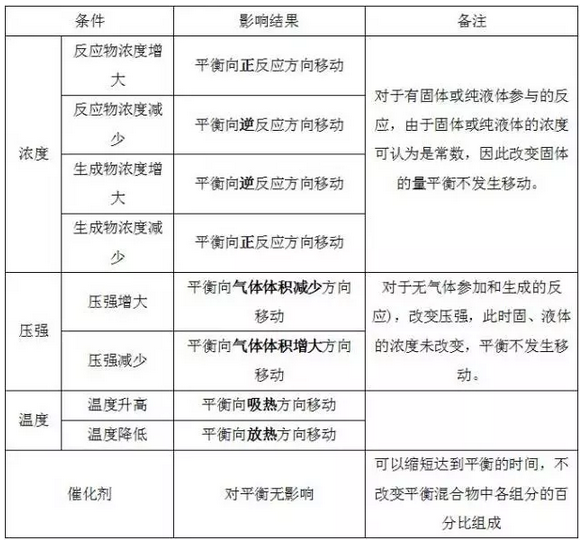
3、影响化学平衡的因素
4、“惰性气体”对化学平衡的影响
①恒温、恒容条件
原平衡体系 体系总压强增大―→体系中各组分的浓度不变―→平衡不移动。
体系总压强增大―→体系中各组分的浓度不变―→平衡不移动。
②恒温、恒压条件
原平衡体系 容器容积增大,各反应气体的分压减小―→体系中各组分的浓度同倍数减小
容器容积增大,各反应气体的分压减小―→体系中各组分的浓度同倍数减小

5、勒夏特列原理
定义:如果改变影响平衡的一个条件(如C、P或T等),平衡就向能够减弱这种改变的方向移动。
原理适用的范围:已达平衡的体系、所有的平衡状态(如溶解平衡、化学平衡、电离平衡、水解平衡等)和只限于改变影响平衡的一个条件。
勒夏特列原理中“减弱这种改变”的解释:外界条件改变使平衡发生移动的结果,是减弱对这种条件的改变,而不是抵消这种改变,也就是说:外界因素对平衡体系的影响占主要方面。
最后,希望精品小编整理的高一上册期中化学平衡的移动必考知识点对您有所帮助,祝同学们学习进步。
精品学习网官方公众平台--【精品高中生】正式上线啦,大家可扫描下方的二维码关注,也可搜索微信号“gk51edu”或者直接输入“精品高中生”进行关注!!我们每天会为大家推送最新的内容哦~

标签:高一化学知识点
免责声明
精品学习网(51edu.com)在建设过程中引用了互联网上的一些信息资源并对有明确来源的信息注明了出处,版权归原作者及原网站所有,如果您对本站信息资源版权的归属问题存有异议,请您致信qinquan#51edu.com(将#换成@),我们会立即做出答复并及时解决。如果您认为本站有侵犯您权益的行为,请通知我们,我们一定根据实际情况及时处理。