鲁科版高二化学同步练习:电池探秘
编辑:sx_liax
2016-09-27
鲁科版高二化学同步练习是电池探秘的练习。当电池使用一段时间后电压下降时,可以给他通以反向电流,使电池电压回升。
鲁科版高二化学同步练习:电池探秘
1.【题文】铁片和锌片用导线连接后插入稀硫酸中,铁片是( )A.负极B.正极C.阳极D.阴极
答案 【答案】B
解析 【解析】
试题分析:铁片和锌片用导线连接后插入稀硫酸中构成原电池。由于锌的金属性强于铁的,所以锌是负极,铁是正极,答案选B。
考点:考查原电池的有关判断
点评:本题是基础性试题的考查,也是高考中的常见题型,试题难度不大。主要是考查学生对基础知识的熟悉掌握程度和灵活运用知识的能力。
2.【题文】原电池的正极一定是( )A.电子流出的极B.电子流入的极
C.发生氧化反应的极D.电极自身参与反应的极
答案 【答案】B
解析 【解析】
试题分析:原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应,所以原电池的正极一定是电子流入的极,答案选B。
考点:考查原电池的有关判断
点评:本题是基础性试题的考查,主要是训练学生的答题能力,增强学生学习化学的兴趣。
3.【题文】关于如图所示装置的叙述,正确的是 ( )
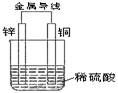
A.铜是阳极,铜片上有气泡产生B.铜片质量逐渐减少
C.电流从锌片经导线流向铜片D.氢离子在铜片表面被还原
答案 【答案】D
解析 【解析】
试题分析:电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。锌的金属性强于铜的,所以根据装置图可知,锌是负极,失去电子,电极质量减少;铜是正极,溶液中的氢离子得到电子被还原而生成氢气,因此正确的答案选D。
考点:考查原电池的有关判断
点评:本题是高考中的常见题型,试题难易适中。主要是考查学生灵活运用知识解决实际问题的能力,提高学习效率。
4.【题文】下图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述不正确的是 ( )
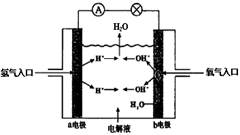
A.a电极是负极
B.b电极的电极反应为:4OH--4e-=2H2O+O2-
C.氢氧燃料电池是一种具有应用前景的绿色电源
D.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
答案 【答案】B
解析 【解析】
试题分析:原电池中负极失去电子,发生氧化反应。正极得到电子,发生还原反应。所以在氢氧燃料电池中氢气在负极通入,氧气在正极通入,因此选项A、C、D都是正确的。B不正确,b电极是正极,电极反应式是2H2O+O2+4e-=4OH-,答案选B。
考点:考查燃料电池的有关判断
点评:本题是高考中的常见题型,思为基础性试题的考查。试题难易适中,主要是训练学生的答题能力,激发学生的学习兴趣,提高学习效率。
精品小编为大家提供的鲁科版高二化学同步练习,大家仔细阅读了吗?最后祝同学们学习进步。
精品学习网官方公众平台--【精品高中生】正式上线啦,大家可扫描下方的二维码关注,也可搜索微信号“gk51edu”或者直接输入“精品高中生”进行关注!!我们每天会为大家推送最新的内容哦~

标签:高二化学同步练习
免责声明
精品学习网(51edu.com)在建设过程中引用了互联网上的一些信息资源并对有明确来源的信息注明了出处,版权归原作者及原网站所有,如果您对本站信息资源版权的归属问题存有异议,请您致信qinquan#51edu.com(将#换成@),我们会立即做出答复并及时解决。如果您认为本站有侵犯您权益的行为,请通知我们,我们一定根据实际情况及时处理。