高中化学焓变与反应热知识点及练习题
来源:51EDU精品学习网 编辑:donghk
2018-09-30 14:28:09
本篇文章为大家带来关于高中化学焓变与反应热知识点及练习题,高中的同学们要认真学习本文中提到的知识点,在考试中灵活运用。
1.化学反应中的能量变化
(1)化学反应中的两大变化:物质变化和能量变化。
(2)化学反应中的两大守恒:质量守恒和能量守恒。
(3)化学反应中的能量转化形式:热能、光能、电能等。通常主要表现为热量的变化。
2.焓变、反应热
(1)定义:在恒压条件下进行的反应的热效应。
(2)符号:ΔH。
(3)单位:kJ·mol-1或kJ/mol。
(4)ΔH的计算方法
ΔH=生成物所具有的总能量-反应物所具有的总能量
ΔH=断键吸收的总能量-成键释放的总能量
ΔH=正反应活化能-逆反应活化能
① 破坏反应物中的化学键吸收的能量越小,说明反应物越不稳定,本身的能量越高。
② 形成生成物的化学键放出的能量越多,说明生成物越稳定,本身的能量越低。
3.吸热反应和放热反应
(1)从反应物和生成物的总能量相对大小的角度分析

(2)从反应热的量化参数——键能的角度分析
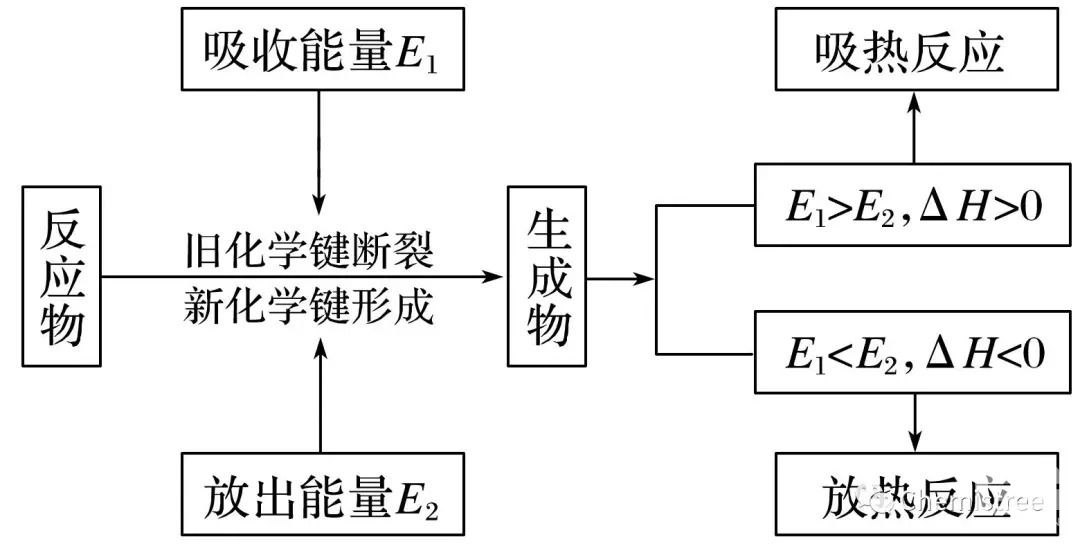
(3)常见的放热反应和吸热反应
放热反应:①可燃物的燃烧②酸碱中和反应;③大多数化合反应;④金属与水或酸的置换反应;⑤物质的缓慢氧化;⑥铝热反应等。
吸热反应:①大多数分解反应;②盐的水解和弱电解质的电离;③Ba(OH)2·8H2O与NH4Cl反应;④碳和水蒸气、C和CO2的反应等。
4.燃烧热 中和热
(1)燃烧热
①概念:在101 kPa时,1mol纯物质完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热。
其中的“完全燃烧”,是指物质中下列元素完全转变成对应的氧化物:C→CO2(g),H→H2O(l),S→SO2(g)等。
②在书写热化学方程式时,应以燃烧 1 mol 物质为标准来配平其余物质的化学计量数。
例如:
C8H18(l)+O2(g)===8CO2(g)+9H2O(l) ΔH=-5 518 kJ·mol-1。
(2)中和热
①概念:在稀溶液中,强酸跟强碱发生中和反应生成1mol液态H2O时的反应热叫中和热。
②离子方程式可表示:
OH-(aq)+H+(aq)===H2O(l) ΔH=-57.3kJ·mol-1。
③中和热的测定原理
c=4.18 J·g-1·℃-1=4.18×10-3 kJ·g-1·℃-1;n为生成H2O的物质的量。
④中和热测定实验
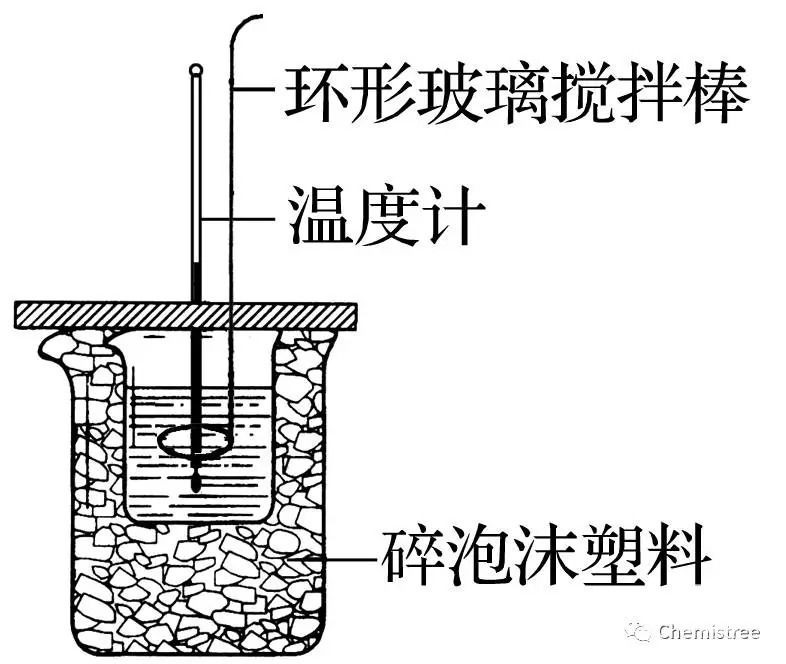
注意事项:
A.碎泡沫塑料板和碎泡沫塑料(或纸条)的作用是保温隔热,减少实验过程中的热量损失。
B.为保证酸完全中和,采取的措施是碱稍过量。
C.因为弱酸或弱碱存在电离平衡,电离过程需要吸热,实验中若使用弱酸、弱碱则测得的反应热数值偏小。
5.正确理解活化能与反应热的关系
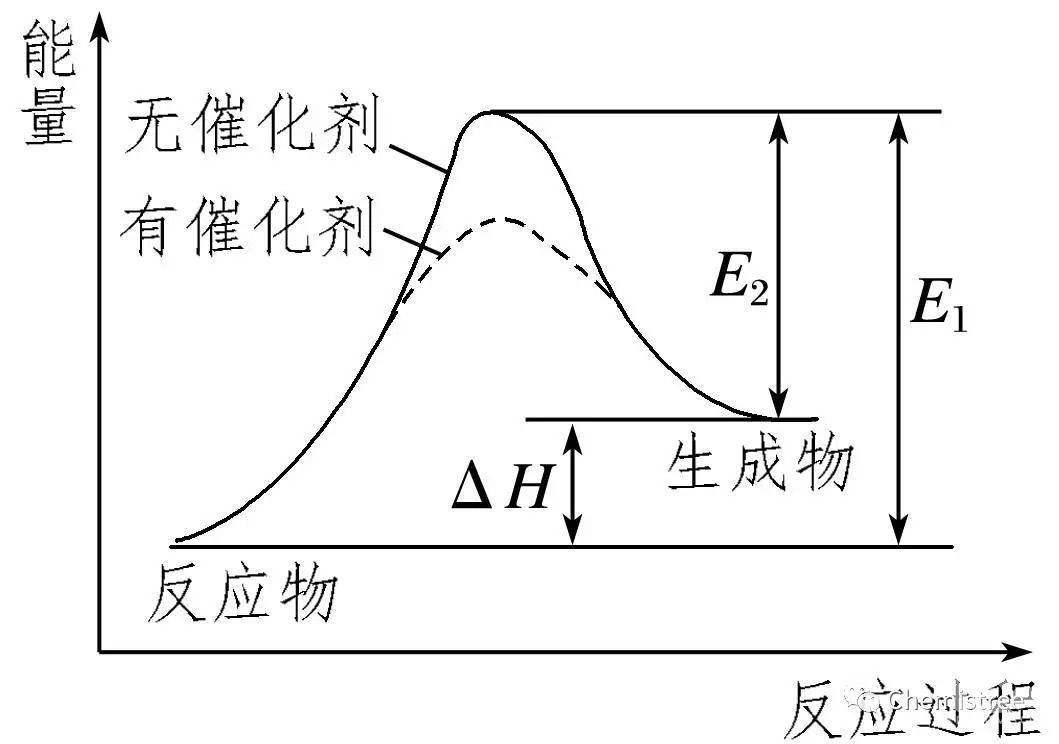
(1)催化剂能降低反应所需活化能,但不影响焓变的大小。
(2)在无催化剂的情况下,E1为正反应的活化能,E2为逆反应的活化能,即E1=E2+|ΔH|。
6.反应热答题规范指导
(1)描述反应热时,无论是用“反应热”、“焓变”表示还是用ΔH表示,其后所跟数值都需要带“+”、“-”符号。如:某反应的反应热(或焓变)为ΔH=-QkJ·mol-1或ΔH=+QkJ·mol-1。
(2)由于中和反应和燃烧均是放热反应,表示中和热和燃烧热时可不带“-”号。如:某物质的燃烧热为ΔH=-Q kJ·mol-1或Q kJ·mol-1。
[page]练习题[/page]
练习题:
1.强酸与强碱的稀溶液发生中和反应的热效应为:H+(aq)+OH-(aq)=H2O(l)△H=-57.3KJ·mol-1。分别向1L 0.5mol·L-1的Ba(OH)2的溶液中加入①浓硫酸;②稀硫酸;③稀盐酸,恰好完全反应的热效应分别为△H1、△H2、△H3,下列关系正确的是[ ]
A.△H1>△H2>△H3
B.△H1<△H2<△H3
C.△H1>△H2=△H3
D.△H1=△H2<△H3
答案:B
2.已知:H+(aq)+OH-(aq)==H2O(l);△H=-57.3 kJ·mol-1。现将一定量的稀盐酸、浓硫酸、稀醋酸分别和1L 1mol·L-1的NaOH溶液恰好完全反应,其反应热分别为△H1、△H2、△H3,则△H1、△H2和△H3的大小关系为[ ]
A. △H1=△H2>△H3
B. △H3>△H2>△H1
C. △H3>△H1>△H2
D. △H2>△H1>△H3
答案:C
3.下列化学反应ΔH的数值中,表示放热最多的是[ ]
A.NaOH(aq)+HCl(aq)=NaCl(aq )+H2O(l);△H1
B.NaOH(aq)+1/2H2SO4(aq)=1/2Na2SO4(aq)+H2O(l);△H2
C.CH3COOH(aq)+NaOH(aq)=CH3COONa (aq )+H2O(l);△H3
D.NaOH(aq)+1/2H2SO4(浓)=1/2Na2SO4(aq)+H2O(l);△H4
答案:D
4.下列各项与反应热的大小无关的是[ ]
A.反应物和生成物的状态
B.反应物的多少
C.反应物的性质
D.反应热的单位
答案:D
5.已知Cl2(g)、Br2(g)分别与H2反应的化学方程式如下:
Cl2(g)+H2(g)=2HCl(g) △H1
Br2(g)+H2(g)=2HBr(g) △H2
有关上述反应的叙述正确的是[ ]
A.△H1>△H2
B.△H1、△H2的大小受反应条件的影响
C.1 mol Cl2所具有的能量小于1 mol Br2(g)所具有的能量
D.工业上从海水中提取溴时,会涉及氧化还原反应
答案:D
以上就是高中化学焓变与反应热知识点及练习题的全部内容,同学们还想了解更多的高中知识,请点击收藏高中资讯频道。
- 2019-05-08 15:23:39
- 2019-05-08 14:51:57
- 2019-05-07 16:34:20
- 2019-05-07 16:16:53
- 2019-05-07 15:57:34
- 2019-05-07 15:55:23
- 2019-05-07 15:47:58
- 2019-05-05 16:03:01
- 2019-05-05 15:51:49
- 2019-05-05 15:25:44
免责声明
精品学习网(51edu.com)在建设过程中引用了互联网上的一些信息资源并对有明确来源的信息注明了出处,版权归原作者及原网站所有,如果您对本站信息资源版权的归属问题存有异议,请您致信qinquan#51edu.com(将#换成@),我们会立即做出答复并及时解决。如果您认为本站有侵犯您权益的行为,请通知我们,我们一定根据实际情况及时处理。
- [原创]高中语文文言文虚词其的用法学习
- [原创]备考:高中语文文言文虚词乃的用...
- [原创]备考:高中语文文言文常见虚词乎...
- [原创]复习:高中语文文言文常见虚词何...
- [原创]高中语文必修五文言文知识点大全
- [原创]高中语文必修四文言文知识点大全
- [原创]高中语文必修三文言文知识点大全
- [原创]11个高中语文修辞手法大全
- [原创]高中语文必修二文言文知识点大全
- [原创]高中语文必修一文言文知识点大全